Flavonoide: Definition, Wirkung, Aufgaben, Einteilung
Definition
Mengenmässig sind die Flavonoide die am häufigsten auftretendenden sekundären Pflanzeninhaltsstoffe der höheren Pflanzen. Sie stellen eine große Strukturvielfalt innerhalb der Gruppe der Polyphenole dar. Es sind ungefähr 6500 Verbindungen bekannt, die je nach Grundstruktur in mehrere Gruppen eingeteilt werden.
Woher kommt der Name?
Der Name leitet sich vom lateinischen Wort flavus = gelb ab. Der Name wurde gewählt, weil die meisten dieser Substanzen in ihrer reinen Form eine gelbliche Farbe aufweisen.
Eine Ausnahme bilden die Anthocyanidine. Es sind blau oder rot gefärbte Stoffe.
Aufgaben von Flavonoide
Flavonoide bieten der Pflanze Schutz vor äußeren schädlichen Einflüssen. Aus diesem Grund finden sich die höchsten Konzentrationen in den äußeren Blättern (z.B. bei Kohlgemüsen, Salaten) oder in Schalen. Die Empfehlung, Äpfel nicht zu schälen oder Tomaten nicht zu häuten hat also durchaus ihre Berechtigung.
Einteilung
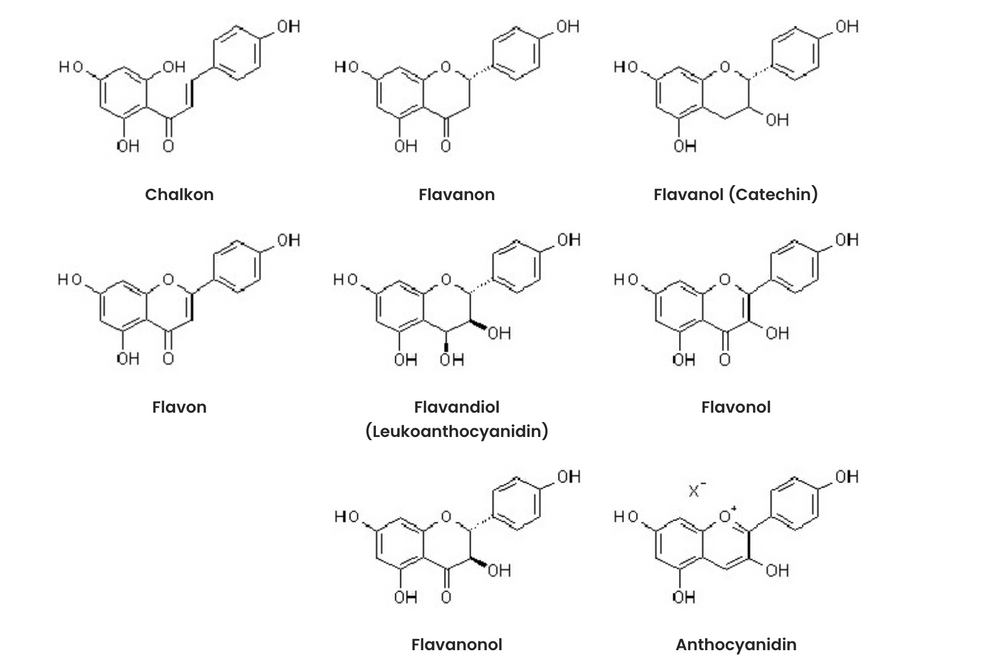
Flavonoide chemische Struktur
Durch die Kondensation von Pflanzensäuren zu einer C6-C3-C6-Verbindung (Chalcon (2-Hydroxyphenyl-styrylketon)) bildet die Pflanze Flavonoide (Ableitung =Chalcone).
Reagiert die phenolische OH-Gruppe mit der Arylkette unter Ringschluss zu einem Fünferring erhält man die Grundstruktur der Aurone (2 Bezyliden-2,3-dihydrobenzofuran-3-on). Der Ringschluss zu einem Sechserring führt zur Grundstruktur der Flavane (2-Phenylchroman), die je nach Oxidationsgrades des sauerstofhaltigen Rings weiteren Grundverbindungen ergeben. So werden Stoffe mit der Struktur Flavan-3-ol als Catechine, Flavan-3,4-diol als Leukoanthocyanidine, Flavyliumsalze als Anthocyanidine bezeichnet. Weitere wichtige Gruppen sind die Flavanone, Flavanonole, Flavone (Flaven-4-on) und Flavonole (3-Hydroxy-flaven-4-on). Isoflavanoide besitzen ein 3-Phenychroman-Grundgerüst (Isoflavan) und werden wie die Catechine und Leukoanthocyanidine, die sich leicht zu größeren Verbindungen zusammenlagern, gesondert besprochen.
Meist kommen Flavonoide als lösliche Glykoside (= Verbindungen mit Zuckermolekülen) im Zellsaft der Pflanze vor.
Sie wurden mit Namen bezeichnet, die sich von den Pflanzennamen der Pflanze ableiten, in der die Verbindung als erstes gefunden wurde. So entstand eine verwirrende Anzahl von Namen.
Zuckerfreie Strukturen werden Aglyka genannt und tragen oft die Endsilbe -genin in ihrem Namen. So ist z.B. das Aglykon des Naringins, einem Flavanon der Zitrusfrüchte, das Naringenin.
Die gesundheitliche Wirkung
Flavonoidreiche Nahrungsmittel besitzen einen krankheitsvorbeugenden Effekt.
Flavonoide verfügen über ein beträchtliches antioxidatives Potential und sind so in der Lage, sehr reaktive Verbindungen, wie sie z.B. durch UV-Strahlung entstehen können, abzufangen und in verträglichere Verbindungen überzuführen, bevor die Zelle Schaden nehmen kann. Mit den antioxidativ wirkenden Vitaminen C und A entsteht ein Synergismus.
Aufgrund dieser Verbindungen setzt die Kosmetikindustrie flavonoidhaltige Pflanzenauszüge immer öfter in Antifalten- und Sonnencremes ein.
Wirkung bei Entzündungen und mehr
Einige der Verbindungen erwiesen sich in Laborversuchen als wachstumshemmend auf Bakterien und Viren, entzündungshemmend, immunmodulatorisch, antihepatotoxisch, antikanzerogen, durchblutungsfördernd, spasmolytisch, diuretisch und antiallergisch.
Möglicherweise kommen die süss schmeckenden Dihydrochalcone als Süssstoffe in Frage.
Die Bioverfügbarkeit von Flavonoiden wurde bislang als problematisch angesehen. Neuere Untersuchungen zeigen jedoch, dass sie durch einen aktiven Prozess im Dünndarm aufgenommen werden.
Flavonoide scheinen für den Menschen ungiftig zu sein. Im Laborversuch konnte man jedoch für einige Aglyka mutagene und genotoxische Wirkungen feststellen. Die Bedeutung dieser Befunde ist jedoch noch unklar.
Die in der Nahrung vorliegende Glykoside haben diese Eigenschaft offensichtlich nicht oder diese werden durch in der Pflanze enthaltenen weiteren Stoffe verhindert. Insofern ist es sicher ratsam sich durch natürliche Nahrungsmittel flavonoidreich zu ernähren anstatt zu Nahrungsergänzungsmitteln zu greifen.
Welche Lebensmittel enthalten Flavonoide?
Flavonoide sind im Pflanzenreich weit verbreitet. Sie kommen praktisch in allen Obst- und Gemüsesorten vor. Aber auch bestimmte Nüsse und Getreidesorten enthalten diese wertvollen Stoffe.
Obst: Äpfel, Beeren (Erdbeeren, Heidelbeeren, Brombeeren), Kirschen, Zitrusfrüchte
Gemüse: Zwiebeln, Grünkohl, Tomaten, Paprika, Sellerie, Karotten
Getränke: Schwarzer und grüner Tee, Rotwein
Andere: Kakao, Soja
Folgende Tabelle zeigt einige Beispiele:
Grundstruktur | Aglykon | Flavonoid | Beispiele |
Flavonole | Quercetin | Spiraeosid | Zwiebel |
|
| Isoquercitrin | Holunderblüten |
|
| Flavonolignane | Mariendistel |
|
| kein Trivialname | Tomate |
|
| kein Trivialname | Ruhrkrautblüten |
|
| kein Trivialname | Preiselbeere |
|
| kein Trivialname | Schnittlauch |
|
| Rutosid | Weinrautenkraut |
|
| Rutosid | Weißdorn |
|
| Hyperosid | Birke |
|
| Hyperosid | Weißdorn |
|
| Hyperosid | Stiefmütterchen |
|
| kein Trivialname | Schachtelhalm |
| Kämpferol | kein Trivialname | Grünkohl |
|
| kein Trivialname | Endivie |
|
| kein Trivialname | Schachtelhalm |
Flavanole | Catechin | Catechingerbstoffe | Odermenning |
|
| Catechingerbstoffe | Heidelbeeren |
|
| kein Trivialname | Pfirsich |
|
| kein Trivialname | Rotwein |
|
| kein Trivialname | Äpfel |
| Epicatechin | kein Trivialname | Aprikose |
|
| Epicatechingallat | Grüner Tee |
| Procyanidine | Procyanidin B-2 | Weißdorn |
|
| Procyanidin B-2 | Mossbeeren |
Flavanone | Hesperetin | Hesperidin | Orange |
|
| Hesperidin | Zitrone |
| Naringenin | Naringin | Grapefruit |
Flavone | Apigenin | Vitexin | Stiefmütterchen |
|
| Isovitexin | Orthosiphon |
|
| Biflavone | Ginkgo |
|
| kein Trivialname | Sellerie |
| Luteolin | Orientin | Passionsblume |
|
| kein Trivialname | Grüne Olive |
|
| kein Trivialname | Paprika |
Anthocyanidine | Malvidin | kein Trivialname | Blaue Trauben |
|
| kein Trivialname | Heidelbeeren |
|
| kein Trivialname | Malvenblüten |
| Delphinidin | kein Trivialname | Johannisbeere |
Dihydrochalcone | Phloretin | kein Trivialname | Äpfel |
Isoflavonoide | Genistein | Genistin | Sojabohnen |
| Formonetin | Ononin | Hauhechel |
Literatur:
Bernhard Watzl, Achim Bub:
Flavonoide Ernährungs-UmschauGunter Metz:
Phytamine – Pflanzliche Nahrung zur Prävention PZ-Schriftenreihe Nr. 13 (2001), Govi VerlagUwe Gröber:
Orthomolekulare Medizin, 2000, Wissenschaftliche Verlagsgesellschaft StuttgartGeorg Schiller, Karl Hiller:
Arzneidrogen, 4. Aufl. 1999, Spektrum Akademischer VerlagHager ROM 2002, Springer Verlag

