Flavonoide
Flavonoide
Mengenmässig sind die Flavonoide die am häufigsten auftretendenden sekundären Pflanzeninhaltsstoffe der höheren
Pflanzen. Sie stellen eine große Strukturvielfalt innerhalb der Gruppe der Polyphenole dar. Es sind ungefähr 6500
Verbindungen bekannt, die je nach Grundstruktur in mehrere Gruppen eingeteilt werden.
Der Name leitet sich vom
lateinischen Wort flavus = gelb ab. Der Name wurde gewählt, weil die meisten dieser Substanzen in ihrer reinen Form
eine gelbliche Farbe aufweisen.
Eine Ausnahme bilden die Anthocyanidine. Es sind blau oder rot gefärbte
Stoffe.
Flavonoide bieten der Pflanze Schutz vor äußeren schädlichen Einflüssen. Aus diesem Grund finden sich
die höchsten Konzentrationen in den äußeren Blättern (z.B. bei Kohlgemüsen, Salaten) oder in Schalen. Die
Empfehlung, Äpfel nicht zu schälen oder Tomaten nicht zu häuten hat also durchaus ihre Berechtigung.
Einteilung:
Durch die Kondensation von Pflanzensäuren zu einer C6-C3-C6-Verbindung (Chalcon (2-Hydroxyphenyl-styrylketon))
bildet die Pflanze Flavonoide (Ableitung =Chalcone).
Reagiert die phenolische OH-Gruppe mit der Arylkette unter
Ringschluss zu einem Fünferring erhält man die Grundstruktur der Aurone (2 Bezyliden-2,3-dihydrobenzofuran-3-on).
Der Ringschluss zu einem Sechserring führt zur Grundstruktur der Flavane (2-Phenylchroman), die je nach
Oxidationsgrades des sauerstofhaltigen Rings weiteren Grundverbindungen ergeben. So werden Stoffe mit der Struktur
Flavan-3-ol als Catechine, Flavan-3,4-diol als Leukoanthocyanidine, Flavyliumsalze als Anthocyanidine bezeichnet.
Weitere wichtige Gruppen sind die Flavanone, Flavanonole, Flavone (Flaven-4-on) und Flavonole
(3-Hydroxy-flaven-4-on). Isoflavanoide besitzen ein 3-Phenychroman-Grundgerüst (Isoflavan) und werden wie die
Catechine und Leukoanthocyanidine, die sich leicht zu größeren Verbindungen zusammenlagern, gesondert besprochen.
Meist kommen Flavonoide als lösliche Glykoside (= Verbindungen mit Zuckermolekülen) im Zellsaft der Pflanze
vor.
Sie wurden mit Namen bezeichnet, die sich von den Pflanzennamen der Pflanze ableiten, in der die Verbindung
als erstes gefunden wurde. So entstand eine verwirrende Anzahl von Namen.
Zuckerfreie Strukturen werden Aglyka
genannt und tragen oft die Endsilbe -genin in ihrem Namen. So ist z.B. das Aglykon des Naringins, einem Flavanon der
Zitrusfrüchte, das Naringenin.
Wirkungen:
Flavonoidreiche Nahrungsmittel besitzen einen krankheitsvorbeugenden Effekt.
Flavonoide verfügen über ein
beträchtliches antioxidatives Potential und sind so in der Lage, sehr reaktive Verbindungen, wie sie z.B. durch
UV-Strahlung entstehen können, abzufangen und in verträglichere Verbindungen überzuführen, bevor die Zelle Schaden
nehmen kann. Mit den antioxidativ wirkenden Vitaminen C und A entsteht ein Synergismus.
Aufgrund dieser
Verbindungen setzt die Kosmetikindustrie flavonoidhaltige Pflanzenauszüge immer öfter in Antifalten- und
Sonnencremes ein.
Einige der Verbindungen erwiesen sich in Laborversuchen als wachstumshemmend auf Bakterien und Viren,
entzündungshemmend, immunmodulatorisch, antihepatotoxisch, antikanzerogen, durchblutungsfördernd, spasmolytisch,
diuretisch und antiallergisch.
Möglicherweise kommen die süss schmeckenden Dihydrochalcone als Süssstoffe in
Frage.
Die Bioverfügbarkeit von Flavonoiden wurde bislang als problematisch angesehen. Neuere Untersuchungen
zeigen jedoch, dass sie durch einen aktiven Prozess im Dünndarm aufgenommen werden.
Flavonoide scheinen für den
Menschen ungiftig zu sein. Im Laborversuch konnte man jedoch für einige Aglyka mutagene und genotoxische Wirkungen
feststellen. Die Bedeutung dieser Befunde ist jedoch noch unklar.
Die in der Nahrung vorliegende Glykoside haben
diese Eigenschaft offensichtlich nicht oder diese werden durch in der Pflanze enthaltenen weiteren Stoffe
verhindert. Insofern ist es sicher ratsam sich durch natürliche Nahrungsmittel flavonoidreich zu ernähren anstatt zu
Nahrungsergänzungsmitteln zu greifen.
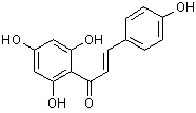 Chalkon |
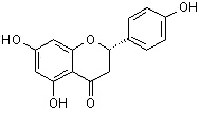 Flavanon |
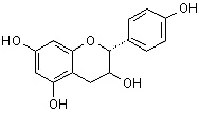 Flavanol (Catechin) |
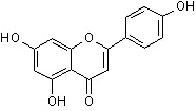 Flavon |
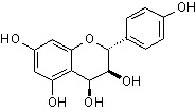 Flavandiol (Leukoanthocyanidin) |
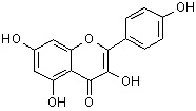 Flavonol |
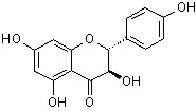 Flavanonol |
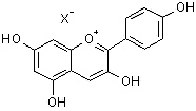 Anthocyanidin |
Vorkommen:
Flavonoide sind im Pflanzenreich weit verbreitet. Sie kommen praktisch in allen Obst- und Gemüsesorten vor. Aber auch bestimmte Nüsse und Getreidesorten enthalten diese wertvollen Stoffe. Folgende Tabelle zeigt einige Beispiele:
| Grundstruktur | Aglykon | Flavonoid | Beispiele |
| Flavonole | Quercetin | Spiraeosid | Zwiebel |
| Isoquercitrin | Holunderblüten | ||
| Flavonolignane | Mariendistel | ||
| kein Trivialname | Tomate | ||
| kein Trivialname | Ruhrkrautblüten | ||
| kein Trivialname | Preiselbeere | ||
| kein Trivialname | Schnittlauch | ||
| Rutosid | Weinrautenkraut | ||
| Rutosid | Weißdorn | ||
| Hyperosid | Birke | ||
| Hyperosid | Weißdorn | ||
| Hyperosid | Stiefmütterchen | ||
| kein Trivialname | Schachtelhalm | ||
| Kämpferol | kein Trivialname | Grünkohl | |
| kein Trivialname | Endivie | ||
| kein Trivialname | Schachtelhalm | ||
| Flavanole | Catechin | Catechingerbstoffe | Odermenning |
| Catechingerbstoffe | Heidelbeeren | ||
| kein Trivialname | Pfirsich | ||
| kein Trivialname | Rotwein | ||
| kein Trivialname | Äpfel | ||
| Epicatechin | kein Trivialname | Aprikose | |
| Epicatechingallat | Grüner Tee | ||
| Procyanidine | Procyanidin B-2 | Weißdorn | |
| Procyanidin B-2 | Mossbeeren | ||
| Flavanone | Hesperetin | Hesperidin | Orange |
| Hesperidin | Zitrone | ||
| Naringenin | Naringin | Grapefruit | |
| Flavone | Apigenin | Vitexin | Stiefmütterchen |
| Isovitexin | Orthosiphon | ||
| Biflavone | Ginkgo | ||
| kein Trivialname | Sellerie | ||
| Luteolin | Orientin | Passionsblume | |
| kein Trivialname | Grüne Olive | ||
| kein Trivialname | Paprika | ||
| Anthocyanidine | Malvidin | kein Trivialname | Blaue Trauben |
| kein Trivialname | Heidelbeeren | ||
| kein Trivialname | Malvenblüten | ||
| Delphinidin | kein Trivialname | Johannisbeere | |
| Dihydrochalcone | Phloretin | kein Trivialname | Äpfel |
| Isoflavonoide | Genistein | Genistin | Sojabohnen |
| Formonetin | Ononin | Hauhechel |
Literatur:
- Bernhard Watzl, Achim Bub:
Flavonoide Ernährungs-Umschau - Gunter Metz:
Phytamine – Pflanzliche Nahrung zur Prävention PZ-Schriftenreihe Nr. 13 (2001), Govi Verlag - Uwe Gröber:
Orthomolekulare Medizin, 2000, Wissenschaftliche Verlagsgesellschaft Stuttgart - Georg Schiller, Karl Hiller:
Arzneidrogen, 4. Aufl. 1999, Spektrum Akademischer Verlag - Hager ROM 2002, Springer Verlag

